|
| Dimitri Mendeleiv (1834-1907) |
Dimitri Mendeleiv foi o senhor que primeiro dispôs os elementos numa tabela periódica, em 1869. Mas como nós sabemos ainda não tinha sido descoberto o eletrão, logo Dimitri organizou os elementos através da massa atómica e organizou-os de forma crescente.
Hoje em dia, já conhecemos o número atómico e organizamos a tabela periódica também por ordem crescente do número atómico.
Nesta tabela existem:
- Na vertical, Grupos
- Na horizontal, Períodos
Grupos
Existem 18 grupos na tabela periódica. São constituídos por elementos com as mesmas propriedades químicas e com o mesmo número de eletrões de valência, formando famílias de elementos. Alguns têm nomes próprios:
- Grupo 1: Metais alcalinos
- Grupo 2: Metais alcalino-terrosos
- Grupo 17: Halogéneos
- Grupo 18: Gases nobres
O número do grupo em que um elemento se encontra relaciona-se com o número de eletrões de valência.
Exemplo:
Lítio (grupo 1) → número atómico 3 Oxigénio (grupo 16) → número atómico 8
2-1 2-6
↓ ↓
1 eletrão de valência 6 eletrões de valência
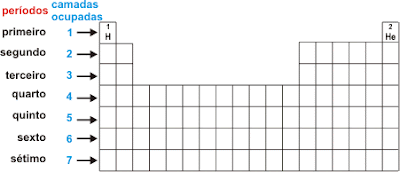
Períodos
Existem 7 períodos na tabela periódica. Ao contrários dos grupos, estes não têm nomes representativos e os elementos organizam-se nos períodos consoante o número de níveis de energia.
Elementos do 1º período → 1 nível de energia
Elementos do 2º período → 2 níveis de energia
Elementos do 3º período → 3 níveis de energia
. .
. .
. .
O número do período em que um elemento se encontra relaciona-se com o número de níveis de energia.
Exemplo:
Sódio (período 3) → número atómico 11 Rubídio (período 5) → número atómico 37
2-8-1 2-8-18-8-1
↓ ↓
3 níveis de energia 5 níveis de energia