Ficha de informação:
Nome e símbolo químico: Carbono (C)
Metais ou Não-metais: Não-metais
Grupo da tabela periódica: 14
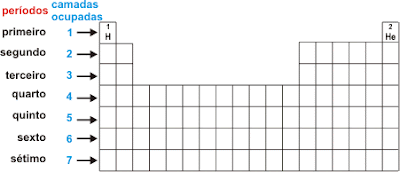
Período da tabela periódica: 2
Massa atómica: 12,001
Número atómico: 6
Já ouviste sim! É mais conhecido como carvão e é utilizado para a produção de aço e também é componente de hidrocarbonetos, como o petróleo e óleos.
Este elemento pode encontrar-se no estado livre ou em combinação com outros elementos, sendo o elemento essencial de toda a matéria viva.
Este elemento é muito importante, pois possui a a propriedade de se ligar consigo mesmo e de formar moléculas, mas também de se ligar a quase todos os outros elementos metálicos e não metálicos, originando uma grande variedade de compostos.